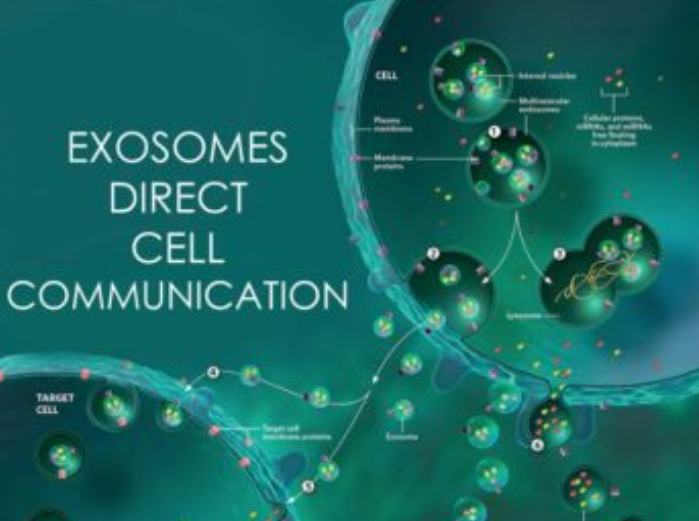
细胞生物学研究发现,各种细胞都会通过释放一种直径为30~100 nm的小型膜囊泡来彼此传递信息,于是把它们命名为“外泌体(exosome)”。结构上讲,外泌体是被脂质双分子层膜包围的膜囊泡,在被称为多囊泡胞内体的细胞内囊泡中产生,多囊泡胞内体与细胞膜的融合后被释放到细胞外。
近年来,外泌体的产生和作用得到了广泛的关注。2013年的诺贝尔生理或医学奖就颁给了三位科学家,James E. Rothman和Randy W. Schekman和Thomas C. Südhof,以表彰他们发现细胞内部囊泡(外泌体等)运输调控机制。使外泌体的研究达到全新的高度。
目前,干细胞、免疫、microRNA、靶向给药、癌症的诊断及治疗等都是外泌体研究的热门领域。
外泌体与免疫
外泌体的研究始于免疫学相关的机制研究。而且,越来越多的研究发现,外泌体与免疫调节的关系尤为密切:外泌体装载着各种免疫相关分子,通过这些分子来调节免疫应答。
这一点有着十分重要的应用价值,通过了解外泌体在免疫系统中的作用,我们就可以利用外泌体开发新型的免疫治疗方法。由于外泌体纳米大小的尺寸和脂质外层特性,将其注入后,很容易通过血液循环到达损伤部位。例如,促进免疫抑制性外泌体的产生,就可以应用于炎症患者或自身免疫疾病患者的治疗上。
外泌体的作用如此重要,那么如何获得对我们有益的外泌体呢?研究表明,与其他类型的细胞相比,间充质干细胞(MSC)可以分泌更多更高质量的外泌体。而反过来说,外泌体也是MSC发挥作用的最重要的途径之一。
外泌体与间充质干细胞(MSCs)
MSCs的外泌体包含细胞因子、生长因子、信号脂质、各种mRNA和调节 miRNA等内容物。这些内容物可以通过参与细胞间的信息传递和信号传导,以及在体内改变细胞或组织代谢,影响机体的损伤修复,并参与免疫、肿瘤等疾病的诊断及治疗。
目前MSCs来源的外泌体已用于包括免疫应答调控模型等多项研究。已有研究显示人类胚胎干细胞来源的MSC也可释放外泌体发挥心肌保护的作用。有研究在小鼠心肌缺血-再灌注损伤模型中发现,心肌内递送MSCs外泌体,调节免疫反应,可使心肌梗死面积减少,有效提高心肌细胞存活率。